Nuevos criterios 2020 para la evaluación de GMPs (Certificados de Buenas Prácticas de Fabricación) por COFEPRIS
Actualización relacionada en Nov 2020: https://rgtconsultores.mx/blog/criterios-2021-para-medicamentos-y-registros-sanitarios
Recientemente (vigentes a partir del 16 de Marzo 2020), se recibió una actualización para la aplicación de criterios que se deben observar para la evaluación de la certificación de Buenas Prácticas de Fabricación (GMPs) de fármacos, medicamentos y dispositivos médicos.
Lo anterior estará dejando sin efecto al oficio circular CAS/19/2018 del 21 de agosto de 2018 - Criterios para Certificados de Buenas Prácticas de Manufactura, así como también a criterios 2019 para la evaluación de GMPs (Certificados de Buenas Prácticas de Fabricación) por COFEPRIS
Los siguientes son algunos puntos a destacar:
5 - Solicitud de Visita de Verificación para Certificación de Buenas Prácticas de Fabricación para Fármacos, Medicamentos, Acondicionamiento Primario y Dispositivos Médicos en México y en el Extranjero, con homoclave COFEPRIS-01-029.
Se agrega 5.1.3. Los productos denominados: biológicos, biofármacos, y de alto riesgo, están sujetos a visitas de verificación por personal de COFEPRIS.
Se agrega apartado 5.2. Solicitudes de Visitas de Verificación para Fabricantes de Fármacos, o Biofármacos de Alto Riesgo.
Se agrega en el punto 5.4. Solicitudes de Visitas de Verificación, información para insumos que no requieren registro sanitario del 2011 (adicional al 2014):
8 - Consideraciones en el Intercambio de Informes / Actas de Inspección.
Se agrega 8.3. Los países con quien actualmente se tiene reconocimiento de actas de verificación son:
a) Colombia a través de su Agencia Reconocida INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos), con la excepción de medicamentos estériles y los considerados de alto riesgo (ver listado de alto riesgo).
b) Argentina a través de su Agencia Reconocida ANMAT (Administración Nacional de Medicamentos, alimentos y Tecnología Médica), con la excepción de medicamentos estériles y los considerados de alto riesgo (ver listado de alto riesgo).
10 - Evaluación del Documento que Acredite las Buenas Prácticas de Fabricación.
10.2. Líneas de Fabricación y/o Productos:
Se agregan definiciones en Fármacos/biofármaco: Se debe indicar el fármaco/biofármaco y/o los procesos certificados, cuando aplique (p.e. granulación, mezclado, micronizado, peletización, pegilación, conjugación, etc.).
10.2.4 - Dispositivos médicos
Se agrega definición para esterilización de dispositivos médicos en el apartado a)
10.2.5. Acondicionamiento Primario
Se agrega sección para el caso del proceso de Acondicionamiento Primario en sitios diferentes al de fabricación del medicamento, ya sea nacional o en el extranjero
11 - Evaluación del Documento que Acredite las BPF para Fabricantes de Fármaco.
Se detalla información para fabricación extranjera, considerando fármacos de alto y bajo riesgo.
14 - Requisitos Legales del CBPF
Se remueve “El CBPF o el documento equivalente deben ser presentados en idioma español, en caso contrario, se debe adjuntar su respectiva traducción al español realizada por perito traductor; de conformidad con el artículo 153, párrafo tercero del Reglamento de Insumos para la Salud.”
15 - Agencias Reguladoras Reconocidas.
Se integran las agencias de EMA, quedando el resultado de la siguiente manera:
Australia - Therapeutic Goods Administration (TGA).
Canadá - Health Canada (HC)*
Estados Unidos de América - Food and Drug Administration (FDA)*
Japón - Ministry of Health, Labour and Welfare, Ministry of Health (MHLW).
Korea - Ministry of Food and Drug Safety of the Republic of Korea (MFDS).
Reino Unido - Medicines and Healthcare Products Regulatory Agency
Suiza - Swiss Agency for Therapeutic Products (Swissmedic)
EMA - European Medicines Agency
Se agregan 15.2. En el caso de Dispositivos Médicos, los documentos equivalentes son:
a) Certificado ISO: 13485 versión vigente emitido por organismo autorizado.
b) Certificado de marca CE para dispositivos médicos emitido por organismo autorizado en la Unión Europea.
c) Declaración de cumplimiento de Buenas Prácticas de Fabricación incluida dentro del Certificado de Libre Venta emitido por la Autoridad Sanitaria o en su caso por el Ministerio correspondiente que regule el producto.
Se agrega 15.2.1.- CBPF, En los Casos donde se Reconocen los Acuerdos de Equivalencia.
A continuación la guía completa para referencia del total de cambios:
GUÍA SOBRE LA APLICACIÓN DE CRITERIOS QUE SE DEBEN OBSERVAR PARA LA EVALUACIÓN DE LA CERTIFICACIÓN DE BUENAS PRÁCTICAS DE FABRICACIÓN DE FÁRMACOS, MEDICAMENTOS, DISPOSITIVOS MÉDICOS Y ALMACENES DE ACONDICIONAMIENTO PRIMARIO QUE ACOMPAÑEN A LAS SOLICITUDES DE MODIFICACIONES, PRÓRROGAS Y REGISTROS SANITARIOS.
1. Objetivo
Establecer los requisitos mínimos que se deben observar para la obtención del oficio de Certificación de Buenas Prácticas de Fabricación (CBPF) y para la evaluación del Certificado de Buenas Prácticas de Fabricación (CBPF) nacional y extranjero.
2. Alcance
Esta guía está dirigida a Fabricantes de Medicamentos, Fármacos, Acondicionamiento primario y Dispositivos Médicos en Territorio Nacional y en el Extranjero, para la evaluación de los Oficios de Certificación de Buenas Prácticas de Fabricación (medicamentos, fármacos, acondicionamiento primario y dispositivos médicos) que acompañen a las solicitudes de modificaciones, prórrogas y registros sanitarios, para medicamentos y dispositivos médicos.
3. Abreviaturas
a) BPF, Buenas Prácticas de Fabricación.
b) COFEPRIS, Comisión Federal para la Protección contra Riesgos Sanitarios.
c) CAS, Comisión de Autorización Sanitaria.
d) COS, Comisión de Operación Sanitaria.
e) CBPF, Certificado de Buenas Prácticas de Fabricación.
f) CBPPE, Certificado de Buenas Prácticas del Proceso de Esterilización.
g) CPP, Certificado de Producto Farmacéutico.
h) MDSAP, Medical Device Single Audit Program (Programa de Auditoría Unificado de Dispositivo Médico).
i) OCBPF, Oficio de Certificación de Buenas Prácticas de Fabricación.
j) RIS, Reglamento de Insumos para la Salud
4. Definiciones
a) Agencia Reconocida, es una Autoridad Reguladora Nacional en materia de medicamentos, a la cual, la Comisión Federal para la Protección Contra Riesgos Sanitarios, le reconoce el documento que acredite las Buenas Prácticas de Fabricación (BPF) para efectos de estos criterios.
b) Deficiencia crítica, Se refiere a cualquier anomalía, adulteración o falsificación que impacte la calidad del producto y que pueda tener como consecuencia una lesión temporal, permanente o la muerte de una persona. Se puede considerar que la relación de varias anomalías clasificadas como mayores pueden derivar a un impacto de nivel crítico.
c) Deficiencia mayor, Aquella anomalía que no puede ser clasificada como crítica y que ha producido o puede producir un producto que no cumpla con su autorización de mercado y puede implicar un desvío de los términos en que fue autorizada la fabricación, o desviaciones a las Buenas Prácticas de Fabricación que puedan tener impacto en la calidad del producto, pero que no representan un riesgo para la salud de las personas, o bien, sea indicativo de falla en el seguimiento satisfactorio del proceso de liberación de lotes .
d) Otras deficiencias, Son las que detectan como fallas en la aplicación del sistema de Gestión de Calidad Farmacéutico o en la aplicación de las Buenas Prácticas de Fabricación, que no comprometen la calidad del producto.
e) Documento equivalente, Documento expedido por una Autoridad Reguladora, el cual avala las Buenas Prácticas de Fabricación del producto.
f) EudraGMDP, Nombre de la base de datos comunitaria de Autorizaciones de Fabricación e Importación y de Certificados de Normas de Correcta Fabricación de Medicamentos (NCF, GMP en inglés).
g) Fármacos de alto riesgo, Se consideran los penicilínicos, carbapenemas, cefalosporínicos, citotóxicos, inmunosupresores, hormonales esteroides de los grupos andrógenos, estrógenos y progestágenos, hemoderivados, y de origen biológicos, biotecnológicos, fármacos considerados como moléculas nuevas (nuevas entidades) y aquellos que tengan alta actividad farmacológica o alta toxicidad.
h) Fármacos de bajo riesgo, Se consideran a todos aquellos que no se encuentren dentro de la definición de fármacos de alto riesgo.
i) País de origen, País en el que se localizan las instalaciones del sitio de fabricación del fármaco o medicamento.
5. Solicitud de Visita de Verificación para Certificación de Buenas Prácticas de Fabricación para Fármacos, Medicamentos, Acondicionamiento Primario y Dispositivos Médicos en México y en el Extranjero, con homoclave COFEPRIS-01-029.
La autoridad sanitaria tendrá como válido la CBPF expedido por la COFEPRIS o el que provenga de alguna de las agencias reguladoras reconocidas por la COFEPRIS, enunciadas en el numeral 15 o por la Autoridad competente del país de origen.
5.1. Generalidades
5.1.1. La solicitud de visita de verificación de fabricantes de medicamentos, fármacos y dispositivos médicos en México y el extranjero que se presentan ante la COFEPRIS será mediante el formato “Autorizaciones, certificados y visitas”, con el trámite con homoclave COFEPRIS-01-029 Solicitud de visita de verificación sanitaria para certificado de buenas prácticas de fabricación de fármacos, medicamentos, Dispositivos médicos y otros insumos para la salud en establecimientos ubicados en México y en el extranjero para el otorgamiento o prorroga del registro sanitario.
5.1.2. La vigencia de 30 meses se otorgará a partir de la fecha de emisión de la Certificación de Buenas Prácticas de Fabricación.
5.1.3. Los productos denominados: biológicos, biofármacos, y de alto riesgo, están sujetos a visitas de verificación por personal de COFEPRIS.
5.1.4. En caso de que durante la visita de verificación y de la evaluación del trámite, persistan anomalías o no den cumplimiento en tiempo y forma de acuerdo a lo indicado en el marco regulatorio, el trámite será desechado y tendrán que someter una nueva solicitud con homoclave COFEPRIS-01-029.
5.2. Solicitudes de Visitas de Verificación para Fabricantes de Fármacos, o Biofármacos de Alto Riesgo.
5.2.1. Debe ser presentada por los titulares del registro sanitario o representantes legales que utilicen fármacos o biofármacos que se consideren de alto riesgo para efectos de estos criterios.
5.2.2. Las visitas de verificación para fabricantes en el extranjero de fármacos o biofármacos se realizarán por producto y sitios declarados que realicen procesos relativos al fármaco o biofármacos.
5.2.3. La visita de verificación de fármacos en México se realizará por línea de fabricación, indicando el método de obtención y las actividades que realizan.
5.2.4. La visita de verificación en el extranjero será de 8 días cuando la solicitud incluya hasta 20 principios activos. Para el caso de solicitudes con 1 o hasta 15 principios activos, la visita de verificación tendrá una duración de 5 días. Los principios activos para la CBPF deben encontrarse en fabricación en alguna de sus etapas es decir en condiciones dinámicas.
5.2.5. No se llevarán a cabo visitas de verificación a fabricantes de fármacos en el extranjero si el fármaco se encuentra en etapa de desarrollo, sin contar con validación del proceso de fabricación; es decir deben estar comercializándose en el país de origen o bien al menos en otro país.
5.3. Solicitudes de Visitas de Verificación para Fabricantes de Medicamentos.
5.3.1. Las visitas de verificación de fabricantes de medicamentos en México se realizarán por línea de fabricación, indicando las formas farmacéuticas y las actividades realizadas.
5.3.2. Las visitas de verificación de fabricantes de medicamentos en el extranjero se realizaran por producto y sitios declarados que realicen procesos relativos al medicamento.
5.3.3. La solicitud de visita de verificación en el extranjero será de 8 días cuando la solicitud incluya hasta 20 productos. Para el caso de solicitudes con 1 o hasta 15 productos, la visita de verificación tendrá una duración en el sitio de fabricación de 5 días. Los productos para la Certificación de Buenas Prácticas de Fabricación deben encontrarse en fabricación en alguna de sus etapas.
5.3.4. Se podrá considerar como un solo producto cuando: el medicamento con el mismo principio activo, forma farmacéutica y diferentes concentraciones, la aceptación de estas agrupaciones será evaluada por la Dirección Ejecutiva de Supervisión y Vigilancia Sanitaria y la Subdirección Ejecutiva de Licencias Sanitarias.
5.3.5. No se llevarán a cabo visitas de verificación a fabricantes de medicamentos en el extranjero, si este se encuentra en etapa de desarrollo, no cuentan con validación del proceso de fabricación, es decir deben estar comercializándose en el país de origen o bien al menos en otro país.
5.4. Solicitudes de Visitas de Verificación para Fabricantes Dispositivos Médicos
5.4.1. Para visitas de verificación sanitaria de Dispositivos Médicos, se llevarán a cabo para aquellos dispositivos médicos que por su naturaleza están sujetos a la obtención de Registro Sanitario exceptuando a los dispositivos indicados en el anexo uno del ACUERDO por el que se da a conocer el listado de insumos para la salud considerados como de bajo riesgo para efectos de obtención del Registro Sanitario, y de aquellos productos que por su naturaleza, características propias y uso no se consideran como insumos para la salud y por ende no requieren Registro Sanitario, DOF 31 de diciembre de 2011.
5.4.2. Para visitas de verificación sanitaria de dispositivos médicos, se llevarán a cabo para aquellos que por su naturaleza están sujetos a Registro Sanitario, por lo que deben consultar el ACUERDO por el que se da a conocer el listado de insumos para la salud considerados como de bajo riesgo para efectos de obtención del Registro Sanitario, y de aquellos productos que por su naturaleza, características propias y uso no se consideran como insumos para la salud y por ende no requieren Registro Sanitario, DOF 22 de Diciembre de 2014. En la siguiente página:
5.4.3. Las visitas de verificación para fabricantes de dispositivos médicos en México se realizarán por línea de fabricación, indicando tipo de dispositivo médico y actividades que realizan.
5.4.4. En las visitas de verificación a fabricantes en el extranjero se realizara por producto.
6. De la Solicitud de Ampliación de Vigencia de las Certificaciones de Buenas Prácticas de Fabricación Emitidos por COFEPRIS, con Homoclave COFEPRIS-05-016, Modalidad A.
6.1. Se podrá extender por seis meses la vigencia de Certificación de Buenas Prácticas de Fabricación, bajo los siguientes criterios:
6.1.1. Que cuenten con una visita de verificación realizada por COFEPRIS con una antigüedad máxima de 12 meses o que se haya realizado la Solicitud de Visita de Verificación Sanitaria para Certificación de Buenas Prácticas de Fabricación de Fármacos, Medicamentos y Otros Insumos para la Salud en Establecimientos Ubicados en México y en el Extranjero para el Otorgamiento o Prórroga del Registro Sanitario (COFEPRIS-01-029) entre 120 a 180 días naturales antes de la finalización de la vigencia del oficio de CBPF.
6.1.2. Que la visita de verificación que se menciona en el párrafo anterior no declare en el acta o en el dictamen deficiencias críticas y/o mayores que pongan en riesgo la calidad del producto o que tengan medidas de seguridad en el establecimiento.
6.1.3. Que no se encuentren suspendidos al momento de la solicitud de la extensión de la vigencia; ya sea a petición de parte o por acción de COFEPRIS.
6.1.4. Que no tenga quejas o denuncias en las cuales ya se haya iniciado un proceso de investigación y/o tenga una resolución pendiente por parte de COFEPRIS.
6.1.5. Para el caso de fabricantes en el extranjero siempre y cuando no cuenten con alerta sanitaria por una agencia reguladora, de lo contrario se procede con la cancelación del trámite respectivo.
6.2. La extensión de la vigencia se da una sola vez por seis meses, a partir de la fecha de vencimiento del Oficio de Certificación vencido o por vencer.
6.2.1. Los establecimientos a los que se les otorgó la Certificación de Buenas Prácticas de Fabricación por revisión documental, no se les podrá extender la vigencia.
6.2.2. No se otorgarán ampliaciones de vigencia de Oficios de Certificación emitidos por el Acuerdo de reconocimiento de Actas/Informes de Inspección entre el Instituto Nacional de Vigilancia de Medicamentos y Alimentos de Colombia (INVIMA) y la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS)
6.2.3. Si antes de que concluya el periodo de extensión de vigencia, se obtiene el Oficio de Certificación con vigencia de 30 meses, debe devolverse el Oficio de Certificación con extensión de vigencia para su cancelación.
6.2.4. Cuando se haya otorgado una ampliación de vigencia y el solicitante cancele su solicitud de visita de verificación, se desista del trámite o en la vista de verificación se detecten anomalías críticas o mayores que pongan en riesgo la calidad del producto, se procederá a la cancelación del oficio de certificación con vigencia ampliada.
6.2.5. La solicitud de ampliación de vigencia debe ser presentada mediante el trámite COFEPRIS-05-016, modalidad A, dirigido a la Subdirección Ejecutiva de Licencias Sanitarias adjuntando copia del ingreso del trámite COFEPRIS-01-029, así como original del Oficio de Certificación vigente.
6.2.6. El comprobante de ingreso de la solicitud de ampliación de vigencia no será considerado un documento equivalente a la Certificación de Buenas Prácticas de Fabricación.
7. Cancelación de Certificación de Buenas Prácticas de Fabricación.
7.1. Cuando el establecimiento, tuviera una visita de vigilancia por COFEPRIS y/o por otra agencia regulatoria reconocida, donde se reporten deficiencias críticas, y/o mayores que pongan en riesgo la calidad del producto.
7.2. Cuando tengan medidas de seguridad o suspensión de actividades parcial o total, se procederá a la cancelación del mismo, fundamentado en el incumplimiento a la Buenas Prácticas de Fabricación. Por lo que será solicitada la Certificación de Buenas Prácticas de Fabricación en original para su cancelación.
7.3. Cuando se tenga reporte de Alerta Sanitaria, con procesos de fabricación, ya sea por COFEPRIS o bien por otra Agencia Reconocida.
8. Consideraciones en el Intercambio de Informes / Actas de Inspección.
8.1. El intercambio de un informe/acta de inspección de otra agencia sanitaria, tiene como finalidad eximir al establecimiento solicitante de una visita de verificación sanitaria y realizar la evaluación de las Buenas Prácticas de Fabricación a través de este mecanismo, siempre y cuando cumpla con los criterios entre las agencias. Para estos casos se considerara la fecha de la visita como el inicio de la vigencia y será por 30 meses.
8.2. COFEPRIS determinará si es procedente la emisión de la Certificación de Buenas Prácticas de Fabricación, utilizando un informe/acta de inspección realizado por otra agencia sanitaria, con base en una evaluación documental y técnica.
8.3. Los países con quien actualmente se tiene reconocimiento de actas de verificación son:
a) Colombia a través de su Agencia Reconocida INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos), con la excepción de medicamentos estériles y los considerados de alto riesgo (ver listado de alto riesgo).
b) Argentina a través de su Agencia Reconocida ANMAT (Administración Nacional de Medicamentos, alimentos y Tecnología Médica), con la excepción de medicamentos estériles y los considerados de alto riesgo (ver listado de alto riesgo).
9. Auditorías
9.1. Las auditorías a fabricantes de fármacos deben estar realizadas de conformidad con lo que establece el numeral 6.2.1.2 Auditorias a proveedores de la “Norma Oficial Mexicana NOM- 059-SSA1- vigente, Buenas prácticas de fabricación de medicamentos”, utilizando como referencia para la elaboración de la lista de verificación a la Norma Oficial Mexicana “NOM- 164-SSA1-vigente, Buenas Practicas de fabricación de fármacos” y Norma Oficial Mexicana “NOM-241-SSA1-vigente, Buenas Prácticas de Fabricación para Dispositivos Médicos.
9.2. Conforme a lo que establece el numeral 6.2.1.2 de la NOM-059-SSA1 vigente, los reportes de auditorías a los fabricantes de fármacos, deben estar disponibles durante las verificaciones sanitarias realizadas por la COFEPRIS a las instalaciones de los Titulares de registro sanitario y a los fabricantes del medicamento. Este último debe tener copia del reporte.
9.3. Si el fármaco es adquirido a través de un distribuidor, la responsabilidad de contar con la evidencia de la evaluación y auditoria es del titular de registro o representante legal del medicamento.
9.4. El distribuidor debe evaluar y calificar al proveedor externo del servicio de auditoria de conformidad con lo estipulado en la “Norma NOM-059-SSA1 vigente Buenas prácticas de fabricación de medicamentos”. Los distribuidores de fármacos podrán realizar la evaluación y auditoria al fabricante del fármaco, si es que demuestran tener la capacidad técnica requerida o a través de un proveedor externo que demuestre tener la capacidad técnica y esta será validada siempre que cumpla con lo establecido en los presentes criterios.
9.5. El incumplimiento a la auditoria al fabricante del fármaco será clasificado como una deficiencia mayor, por lo que se considerará como no cumplido el requisito para la solicitud de modificaciones, prorrogas y registros sanitarios de medicamentos. Este incumplimiento será notificado a la Dirección Ejecutiva de Autorización de Productos y Establecimientos de la COFEPRIS para iniciar, en su caso el procedimiento de revocación de la autorización otorgada.
9.6. Los titulares del registro sanitario deben entregar un reporte anual que incluya el programa de auditoria a fabricantes de principios activos considerados de bajo riesgo, el avance del programa, el reporte ejecutivo de cada una de las auditorias y la evidencia de la asistencia al sitio de fabricación auditado.
10. Evaluación del Documento que Acredite las Buenas Prácticas de Fabricación.
La autoridad sanitaria tendrá como válido el CBPF expedido por la COFEPRIS o el que provenga de alguna de Agencia Reconocida por la COFEPRIS, enunciadas en el numeral 15 o por una la autoridad competente del país de origen, conforme a esta Guía. Para la evaluación de una solicitud de trámite de registro sanitario, modificación o prórroga, en la que se acompaña del documento que acredite las Buenas Prácticas de Fabricación (CBPF), conforme a esta Guía, se debe dar cumplimiento con lo contenido en este apartado.
a) Podrá presentar el documento Original o copia Certificada del mismo emitido por una Agencia reconocida o por una la autoridad competente del país de origen y apagarse al artículo 153 del RIS.
b) Cuando el documento sea presentado en copia Certificada, ésta debe ser completa y legible.
c) La autoridad podrá solicitar el original para cotejo, en cualquier momento.
10.1. Elementos que Integran un CBPF.
10.1.1. Datos del Fabricante:
a) Razón social completa.
b) Domicilio del sitio de fabricación; y cuando aplique la dirección de los otros sitios involucrados en el proceso de obtención del producto.
10.2. Líneas de Fabricación y/o Productos:
10.2.1. Fármacos/biofármaco: Se debe indicar el fármaco/biofármaco y/o los procesos certificados, cuando aplique (p.e. granulación, mezclado, micronizado, peletización, pegilación, conjugación, etc.).
10.2.2. Medicamentos: debe indicar la línea de fabricación y los procesos Certificados, cuando aplique, o podrá indicar el nombre del medicamento que se Certifique.
10.2.3. Vacío
10.2.4. Dispositivos médicos: debe indicar la línea de fabricación y/ o productos, así como los
procesos Certificados, o podrá indicar el nombre del dispositivo médico, que se Certifique.
a) En el caso del proceso de esterilización para dispositivos médicos en territorio Nacional, se realice en otro sitio u otro establecimiento diferente al fabricante debe presentar la Certificación de Buenas Prácticas del Proceso de Esterilización (CBPPE), con la finalidad de que pueda ser incluido en el Registro Sanitario.
10.2.5. Acondicionamiento Primario: En el caso del proceso de Acondicionamiento Primario en sitios diferentes al de fabricación del medicamento solo en territorio Nacional, debe presentar la Certificación de Buenas Prácticas del Proceso de Acondicionamiento Primario que refleje la línea y/o los procesos certificados. Para el caso de Acondicionado en el extranjero de un sitio diferente al del fabricante del medicamento, debe presentar el CBPF emitido por una Agencia reconocida.
10.3. Vigencia
10.3.1. La Certificación de Buenas Prácticas de Fabricación o el documento equivalente debe encontrarse vigente al momento del ingreso de la solicitud de registro sanitario, modificación o prórroga.
10.3.2. Debe mantenerse vigente la Certificación de Buenas Prácticas de Fabricación durante la vigencia del registro sanitario.
10.3.3. En el caso de Certificación de Buenas Prácticas de Fabricación de Otras Agencias Sanitarias, se considerará la vigencia que esta expresada en el documento emitido por la autoridad competente. En caso de que no se indique una vigencia, se considerarán treinta meses a partir de la fecha de emisión del documento que respalde el cumplimiento a las Buenas Prácticas de Fabricación, de conformidad con los artículos del 167 al 170 del Reglamento de Insumos para la Salud, vigente.
10.3.4. En caso de que la Certificación de Buenas Prácticas de Fabricación, se encuentre en proceso de renovación por la COFEPRIS, la vigencia podrá ser extendida, conforme a los criterios establecidos en el numeral 6.
11. Evaluación del Documento que Acredite las BPF para Fabricantes de Fármaco.
11.1.1. Fabricación Nacional:
Se debe presentar CBPF emitido por la COFEPRIS
11.1.2. Fabricación Extranjera:
11.1.2.1. Fármacos de Alto Riesgo, se debe presentar el CBPF expedido por la COFEPRIS o que provenga de alguna Agencia Reconocida, enunciadas en el numeral 15.
a) Consultar la página WEB que a continuación se indica para verificar que el fármaco es de alto riesgo. En el caso que este producto no se encuentra en listado, pero su actividad farmacológica está considerada en alguna de las categorías del listado o se tienen alguna duda sobre su clasificación, deberá de realizar la consulta por escrito a la Dirección Ejecutiva de Autorización de Productos y Establecimientos, de la COFEPRIS, para determinar la inclusión o exclusión del fármaco en cuestión.
11.1.2.2. Fármacos de Bajo Riesgo, se debe presentar el CBPF o el documento equivalente según corresponda la Agencia Reconocida, conforme a los numerales 15 o el CBPF emitido por la autoridad competente del país de origen; conforme lo siguiente:
a) Asegurar que no se encuentra en el listado de fármacos de alto riesgo; en su caso no será necesario la solicitud de CBPF para ser realizada por la COFEPRIS.
b) En caso que la Certificación de Buenas Prácticas de Fabricación sea emitido por una Agencia Reguladora que no cuente con reconocimiento, el titular del registro sanitario o su representante legal debe realizar auditoria al proveedor conforme a lo establecido en el numeral 9. Los reportes de auditoría para los fabricantes de fármacos deben estar disponibles durante las verificaciones sanitarias realizadas por la COFEPRIS a las instalaciones de los titulares de registro sanitario o a los fabricantes del medicamento, este último debe tener copia del reporte. Estos reportes no deben de presentarse en la solicitud de trámite.
11.2. Otros Fármacos. Para el caso en que el fármaco presente en la formulación del medicamento, no se encuentre enlistado en la Farmacopea de los Estados Unidos Mexicanos o en la del país de origen, no se considere como fármaco, a los minerales, vitaminas, siliconas, ascorbatos, carbomeros, políeteres, entre otros, y que además, en el país de origen no se emitan CBPF por la naturaleza de los mismos, incluidos los fármacos de origen homeopático y herbolario, deben someter los siguientes documentos:
11.2.1.1. Copia certificada del documento expedido por una entidad internacional
reconocida que certifique el Sistema de Gestión de Calidad del Fabricante. Deben dar cumplimiento al numeral 14 de los presentes criterios.
11.2.1.2. Documentos emitidos por el solicitante o titular del registro sanitario o el representante legal donde exprese que por la naturaleza de la molécula no se expiden Certificación de Buenas Prácticas de Fabricación al fabricante, incluyendo la razón social y domicilio del fabricante.
11.2.1.3. Certificado analítico expedido por el fabricante del país de origen y por el fabricante del medicamento.
11.2.1.4. Carta emitida por el fabricante del fármaco en el que indique la razón social y sitio de fabricación completo.
12. Evaluación del Documento que Acredita las BPF para Fabricantes de Medicamento.
12.1.1. Fabricación Nacional: Se debe presentar CBPF emitido por la COFEPRIS.
12.1.2. Fabricación extranjera: se debe presentar el CBPF emitido por la COFEPRIS o por una Agencia Reconocida, conforme al numeral 15.
13. Evaluación del Documento que Acredite las Buenas Prácticas de Fabricación para Dispositivos Médicos.
La autoridad sanitaria tendrá como válido la CBPF expedido por la COFEPRIS o el que provenga de alguna de las Agencias Reconocidas por la COFEPRIS, referenciado en el numeral 15.2.
13.1.1. Fabricación Nacional: Se debe considerar el CBPF emitido por la COFEPRIS.
13.1.2. Fabricación Extranjera: Se considera el CBPF emitido por la Autoridad Sanitaria del país de origen o sus equivalentes.
14. Requisitos Legales del CBPF
14.1. Documentos Emitidos con Firma Autógrafa:
El CBPF o el documento equivalente emitido en el extranjero, por alguna Agencia reguladora o por una la autoridad competente del país de origen, debe encontrarse apostillado o legalizado.
14.1.1. Sobre La Apostilla.
a) Debe verificarse si el Estado que expide el documento forma parte de la Convención de la Haya sobre la Apostilla, para ello, puede consultarse la página electrónica https://www.Hcch.net/en/instruments/conventions/status-table/?cid=41; en caso de que el Estado emisor no se encuentre en dicho listado, debe presentarse la legalización del documento, con fundamento en el artículo 546 del Código Federal de Procedimientos Civiles;
b) La apostilla debe cumplir con el formato que establece la Convención.
c) La apostilla puede ser sobre el documento original, o bien sobre una copia certificada por notario público del país que expidió el certificado, y que en ambos casos la apostilla debe ser realizada por las autoridades designadas por el Estado del país que expidió el certificado.
d) En caso de ser una copia certificada, debe ser legible la firma y nombre del funcionario que expidió el documento original.
14.1.2. Sobre La Legalización
a) En el caso de documentos públicos que no sean susceptibles de apostillarse por dirigirse a países que no forman parte de la Convención, podrán ser legalizados a efecto de certificar la autenticidad de las firmas que ostentan los documentos, de los sellos y la calidad que los signatarios hayan actuado.
b) El CBPF o el documento equivalente podrá ser sujeto a legalización, a pesar de haber sido expedido por un Estado adherido a la Convención de la Haya sobre la Apostilla.
c) La legalización y la apostilla deben de realizarse en el país que expidió la Certificación de Buenas Prácticas de Fabricación o el documento equivalente.
14.2. Documentos Emitidos con Firma Electrónica
14.2.1. En caso de que la Certificación de Buenas Prácticas de Fabricación contenga una firma electrónica debe entregarse impreso y/o digitalizado y éste será aceptado cuando su validez y autenticidad puedan ser comprobados a través de los sitios oficiales de las Autoridades extranjeras que los emitan. El promovente debe remitir, según aplique, la ruta de acceso completa, el usuario y contraseña.
14.2.2. No requiere presentar apostilla ni legalización.
14.3. Documentos Emitidos Sin Firma Autógrafa y en Formato Electrónico
14.3.1. En caso de que la Certificación de Buenas Prácticas de Fabricación sea expedido electrónicamente debe entregarse impreso y/o digitalizado y éste será aceptado cuando su validez y autenticidad puedan ser comprobados a través de los sitios oficiales de las Autoridades extranjeras. Esta autoridad reconoce los albergados en el sitio EudraGMDP siempre y cuando la autoridad reguladora que los reconozca esté contemplada en el numeral 12. El promovente debe remitir, según aplique, la ruta de acceso completa, el usuario y contraseña adjuntando esta información en su solicitud.
14.3.2. No requiere presentar apostilla ni legalización.
14.3.3. En caso de que el documento no pueda ser validado a través de la página del sitio oficial de la Autoridad competente, este será prevenido y debe remitir la Certificación de Buenas Prácticas de Fabricación expedido con una firma autógrafa o electrónica. Si existe alguna discrepancia entre el documento electrónico y el que cuente con firma autógrafa o electrónica, prevalecerá el que tenga firma autógrafa o electrónica.
14.3.4. Para el caso en el que el promovente de la solicitud de trámite, presente la Certificación de Buenas Prácticas de Fabricación vigente al momento de realizar su petición y este certificado pierda su vigencia en el proceso de evaluación de su petición, esta autoridad verificara en el sitio de EudraGMP y tomará las consideraciones pertinentes de cambios críticos que se encuentren al momento de verificar la continuidad de la vigencia del fabricante que albergue dicho sitio.
En todos los casos, esta autoridad se reserva la facultad de consultar a las Autoridades Sanitarias del país que expida la Certificación de Buenas Prácticas de Fabricación para corroborar la validez del mismo.
15. Agencias Reguladoras Reconocidas.
15.1. Reconocimiento del CBPF emitido por las siguientes autoridades reguladoras:
Australia - Therapeutic Goods Administration (TGA).
Canadá - Health Canada (HC)*
Estados Unidos de América - Food and Drug Administration (FDA)*
Japón - Ministry of Health, Labour and Welfare, Ministry of Health (MHLW).
Korea - Ministry of Food and Drug Safety of the Republic of Korea (MFDS).
Reino Unido - Medicines and Healthcare Products Regulatory Agency
Suiza - Swiss Agency for Therapeutic Products (Swissmedic)
EMA - European Medicines Agency
* Reconocimiento del CPP como documento equivalente a CBPF.
15.2. En el caso de Dispositivos Médicos, los documentos equivalentes son:
a) Certificado ISO: 13485 versión vigente emitido por organismo autorizado.
b) Certificado de marca CE para dispositivos médicos emitido por organismo autorizado en la Unión Europea.
c) Declaración de cumplimiento de Buenas Prácticas de Fabricación incluida dentro del Certificado de Libre Venta emitido por la Autoridad Sanitaria o en su caso por el Ministerio correspondiente que regule el producto.
15.2.1.- CBPF, En los Casos donde se Reconocen los Acuerdos de Equivalencia.
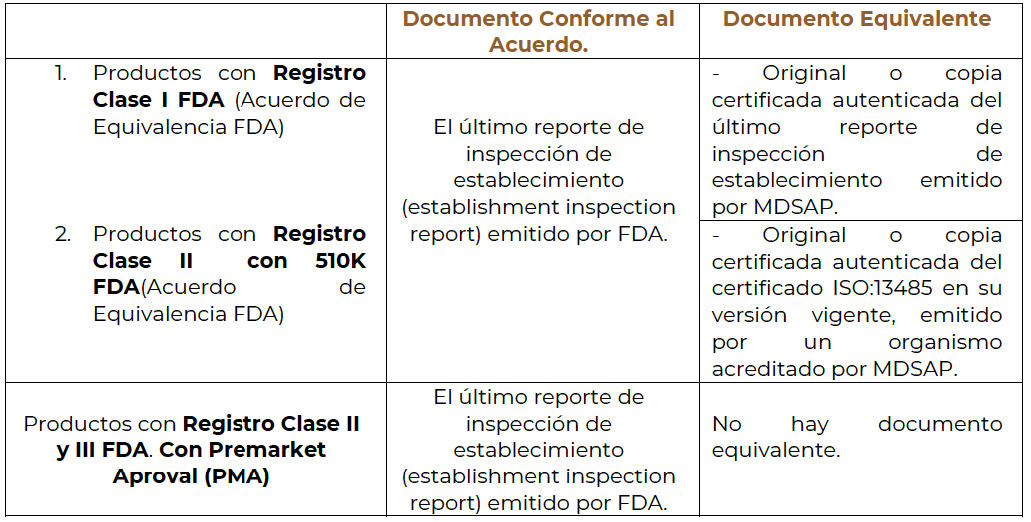
Para el caso del Acuerdo de Equivalencia E.U.A. y Canadá, se deberá cumplir con lo señalado en cada acuerdo citado para su reconocimiento, en el registro de Dispositivos Médicos. Se podrán considerar los documentos señalados en la siguiente tabla, como Equivalentes al Reporte Inspección del Establecimiento para el caso del Acuerdo de Equivalencia FDA:
Acuerdo de Equivalencia FDA para Dispositivos Médicos
Se podrán considerar los documentos señalados en la siguiente tabla como equivalentes a lo correspondiente del Acuerdo de Equivalencia Health Canadá.
Acuerdo de Equivalencia Health Canadá para Dispositivos Médicos.
15.3. No se Considera Equivalente la Certificación de Buenas Prácticas de Fabricación, los siguientes documentos:
a) Los Certificados de Adecuabilidad (Certificate of Suitability).
b) No se considera como equivalente a Certificación de Buenas Prácticas de Fabricación el “Written confirmation for active substances exported to the European Union (EU) for medicinal products for human use”, presentado para los tramites antes mencionados.
c) Informes/actas de inspección de otras agencias sanitarias, EIR (Establishment Inspection Report).
16. Observaciones del Registro
16.1. Para el caso de la nota al calce sobre la presentación del CBPF de Agencia Reconocida, sobre el fabricante de fármaco considerado como bajo riesgo, ésta se podrá eliminar en cualquier trámite, siempre y cuando haya presentado el CBPF emitido por la agencia del país de origen.
16.2. Para dar cumplimiento con la nota al calce sobre el fabricante de fármaco considerado como alto riesgo, el usuario podrá solicitar en cualquier trámite la eliminación de la misma, siempre y cuando presente el documento vigente emitido por COFEPRIS o por una Agencia reconocida establecida en el numeral 15, cumpliendo con su adecuada presentación del CBPF con base en el numeral 14. En caso de no presentarlo en el trámite que se esté evaluando en esta Comisión, será punto de prevención en el que se le solicite que cumpla con lo requerido, aun cuando este punto no sea requisito del trámite que haya aplicado.
17. Validez
El presente documento entra en vigor a partir del 16 de marzo de 2020.
Referencia:
Gob.mx. 2020. COFEPRIS. [online] Available at: <https://www.gob.mx/cms/uploads/attachment/file/539408/Guia_sobre_la_aplicacion_de_criterios_Certificacion_de_Buenas_Practicas_de_Fabricacion_ver._06_de_marzo_de_2020.pdf> [Accessed March 2020].